Nat Commun | 中山医学院董俊超教授团队发现组蛋白甲基转移酶组分CFP1调控B细胞生发中心命运走向的分子机制
B细胞在次级淋巴器官被抗原刺激后形成生发中心(germinal center,GC),经历阳性选择和亲和力成熟后,最终分化为记忆B细胞(MBC)和长寿命浆细胞(PC),通过分泌高亲和力抗体介导体液免疫应答,在清除外来抗原感染中发挥重要作用。GCB细胞的亲和力成熟与终末分化过程受到表观遗传机制精密调控的转录程序的严格约束。其中,二价基因(bivalent genes,即那些启动子区域同时存在激活标记H3K4me3和抑制标记H3K27me3)在调控细胞命运抉择中具有重要作用。目前,组蛋白甲基转移酶EZH2在GC B细胞中催化H3K27me3修饰并维持转录抑制的功能已较为明确;然而,介导激活性H3K4me3在GC B细胞中的沉积的特异性表观因子及其在调控GCB细胞动态变化和终末分化中的作用仍不清楚,有待进一步研究。
2025年8月,中山大学董俊超教授团队在Nature communications杂志上发表题为“CFP1 promotes germinal center affinity maturation and restrains memory B cell differentiation through H3K4me3 modulation”的研究论文,该研究揭示了组蛋白甲基转移酶组分CFP1通过调控H3K4me3修饰(并在部分基因位点协调H3K27me3修饰),在生发中心B细胞反应的各个阶段(包括增殖、亲和力成熟和终末分化)发挥关键作用。
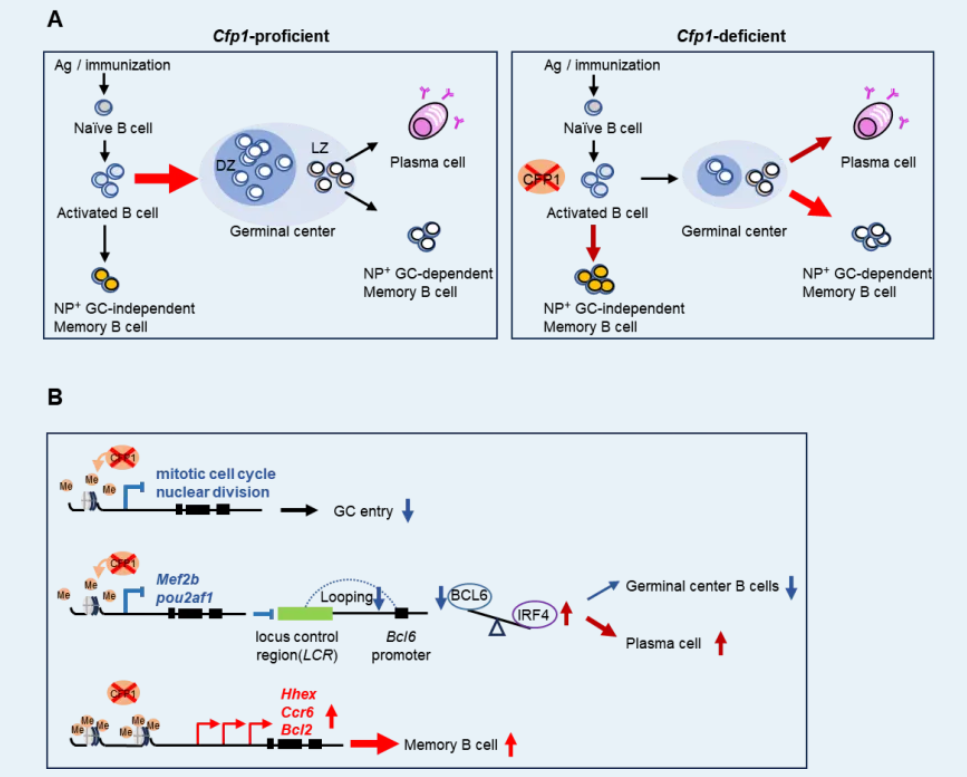
研究团队在B细胞中阶段特异性的敲除CFP1,发现在初始B细胞中删除CFP1,会导致活化前体细胞生成受阻,几乎无法形成GC B细胞。为避开B细胞活化阶段CFP1缺陷对生发中心产生的影响,研究人员进一步在B细胞活化后特异性敲除CFP1。结果显示,虽然此时活化前体细胞的产生未受影响,但成熟GC B细胞的形成仍然受到显著抑制。体细胞高频突变和抗体亲和力成熟过程也出现严重障碍,提示GC B细胞的终末分化可能受损。进一步研究表明,CFP1缺陷导致抗原激活的B细胞增殖能力下降,并倾向于直接分化为滤泡外记忆B细胞;少数仍能形成生发中心的细胞也会提前退出GC反应,并倾向于分化为记忆B细胞和浆细胞。
为探究CFP1如何调控细胞增殖、GC维持与终末分化命运,研究团队通过组蛋白修饰与转录组分析发现,CFP1通过介导H3K4me3修饰正向调控细胞周期相关基因的转录(这些基因多为仅受H3K4me3修饰的活性基因),从而保证GCB细胞的正常增殖。另一方面,CFP1通过调控MEF2B/OCA-B的表达,并促进BCL6增强子区域H3K4me3从活性启动子朝二价启动子转移,共同促进染色质环化介导的BCL6表达,参与GC的建立与维持。CFP1缺失导致BCL6表达显著下降,解除其对IRF4的转录抑制,从而驱动GC B细胞向浆细胞分化。同时,由于BCL6水平降低及部分基因位点H3K4me3异常升高而抑制二价启动子状态,记忆前体B细胞相关基因(如Hhex、Ccr6、Bcl2等)表达上调,共同促使GC B细胞向记忆B细胞方向分化。此外,我们还观察到炎症相关因子的显著表达及H3K4me3水平的整体上调,且其中部分靶基因与MBC通路成员存在重叠。这一现象提示炎症-表观遗传-MBC轴之间可能存在尚未阐明的协同机制,可以启发后续研究。
综上所述,本研究系统揭示了CFP1在调控B细胞活化、生发中心(GC)反应及细胞命运决定中的核心机制。CFP1通过动态调节GC B细胞中关键基因位点的H3K4me3与H3K27me3修饰水平,影响下游基因表达程序,从而精确调控GC B细胞的增殖、抗体生成及亲和力成熟过程。特别值得注意的是,CFP1对维持GC B细胞身份和抑制其过早分化具有重要作用:其缺失可引起分化相关基因启动子区域H3K4me3异常升高而抑制二价启动子状态,进而促使GC B细胞异常分化为浆细胞和记忆B细胞,最终破坏GC反应的正常进程。上述结果表明,CFP1作为关键的表观遗传调控因子,全面参与了GC B细胞从形成、维持到终末分化的全过程。
中山大学中山医学院的董俊超教授及中山大学附属第七医院的白婉瑜博士后为共同通讯作者;团队成员赵亚楠博士和龚铄旭博士为共同第一作者。此外,团队的杨雅琳、陆奕淼、白靖宁和刘美伶也对该项工作做出了一定的贡献。