杨建荣教授和陈小舒教授合作发现细胞表型异质性调控新机制
近日,我院杨建荣教授团队和陈小舒教授团队在表型异质性及其调控机制方面研究取得新进展,研究结果(Bidirectional genetic control of phenotypic heterogeneity and its implication for cancer drug resistance)于2020年12月23日在进化生物学领域国际知名杂志Molecular Biology & Evolution(CiteScore进化生物学领域排名第二)在线发表。
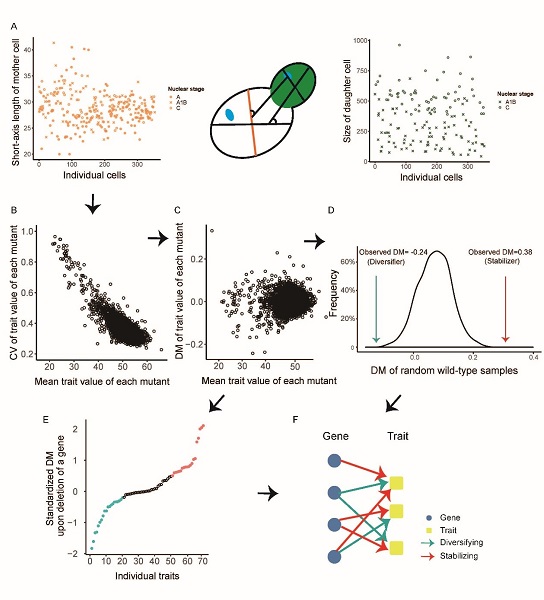
在遗传背景相同一群细胞中,各个细胞的表型仍可能存着显著差异,这个现象被称为表型异质性。在进化生物学领域,表型异质性被认为是细胞面对极端或频繁扰动环境时的生存策略。遗传机制在表型异质性精细调节中发挥重要作用,以酵母Hsp90蛋白为例,如Hsp90功能生效,蛋白质折叠错误带来的表型变化会被隐藏,引起表型异质性降低;反之,如Hsp90功能失效,表型异质性则会增加。经典研究认为表型异质性的正负调控都是由同一批基因的开/关完成。但是,最新研究发现微生物中存在主动提升表型异质性的基因。因此,研究团队展开了相关的研究分析表型异质性受到的正、负调控是否为同一批基因在不同时空执行的相反功能,还是为具有独立功能的两批不同基因完成。
研究团队利用酿酒酵母的4,718个单基因敲除菌株的细胞形态数据,通过量化基因缺失后表型异质性增加/减少的程度,系统地鉴定了324个表型缓冲器(其功能是降低异质性)和160个表型扰动器(其功能是提升异质性),并构建了这些基因对细胞形态性状的调控网络。研究发现,缓冲器与扰动器是几乎互不重叠的两类基因;比起缓冲器,扰动器会以较小幅度调节较多性状,但其在进化上的重要性不亚于缓冲器;重要(即与细胞增殖能力相关度高)的表型会受到较多缓冲器的调控,而扰动器基因的影响则有限;另外,缓冲器和扰动器之间有较明确分工,即较少出现抑制某性状异质性的同时提升其他性状异质性的现象。鉴于表型异质性与耐药性的关系,研究还分析了酵母缓冲器/扰动器在人类基因组中的同源基因,并发现它们确实能降低(缓冲器)/提升(扰动器)常见人类癌细胞系的化疗药耐受性。该研究表明细胞表型异质性受到独立的正、负调控机制影响,揭示了两方面的调控系统都具有重大的进化意义,并提示抑制表型异质性可能是避免肿瘤产生耐药性,提升治疗成功率的有效手段。
陈小舒教授团队硕士研究生莫宁为该论文的第一作者,杨建荣教授和陈小舒教授是论文的共同通讯作者。本研究受到国家传染病防治重大专项,国家自然基金委面上项目的支持。
论文链接:https://academic.oup.com/mbe/advance-article/doi/10.1093/molbev/msaa332/6046000
(初审:谭勇,审核:王斌,审核发布:吴忠道)



