我院陈俊教授团队在巨噬细胞肿瘤免疫领域取得系列进展在Cell Reports,J Leukoc. Biol. 杂志发表
近年来基于巨噬细胞的肿瘤免疫疗法受到越来越多关注,CD47-SIRPa是巨噬细胞上最重要的抑制性免疫检查点之一。肿瘤细胞高表达CD47,通过与抑制性免疫受体信号调节蛋白SIRPa结合,进而抑制巨噬细胞吞噬作用。CD47-SIRPa信号通路的阻断有效激活巨噬细胞对肿瘤细胞的吞噬作用及下游的抗肿瘤免疫反应。我院陈俊教授团队前期研究发现阻断CD47-SIRPa可以促进巨噬细胞吞噬血液瘤细胞,但在实体瘤细胞中的作用有限,该吞噬依赖于肿瘤细胞表达SLAMF7及激活巨噬细胞上SLAMF7信号通路(Nature, 2017)。随着在研药物临床前研究及临床试验的开展,靶向CD47药物的研制前景不断展现出来,但大部分的适应症集中于恶性血液瘤,极少针对于实体瘤,客观验证了团队前期的研究工作。
2021年5月14日,我院陈俊教授团队在Journal of Leukocyte of Biology杂志发表题为Poly(I:C) enhances the efficacy of phagocytosis checkpoint blockade immunotherapy by inducing IL-6 production 的最新研究论文。该研究阐明,Poly(I:C)通过诱导IL-6的产生,从而促进CD47抗体的治疗实体肿瘤的效果。
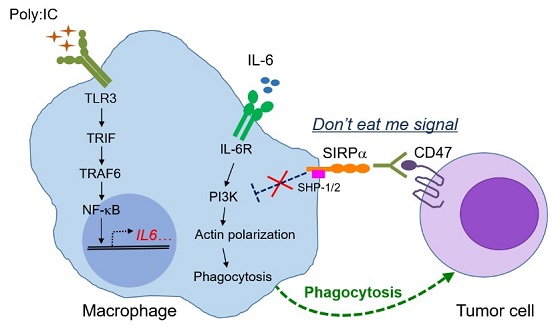
本文通过体外吞噬实验和体内实体瘤动物模型,发现Poly(I:C)与CD47抗体的联合作用促进了巨噬细胞对结肠癌细胞的吞噬能力,抑制了肿瘤的生长。Poly(I:C)通过激活TLR3产生IL-1β和IL-6等炎性细胞因子,体外实验表明IL-6刺激的巨噬细胞在CD47抗体的作用下,明显提高巨噬细胞吞噬,敲除IL-6能减弱Poly(I:C)与CD47抗体联用后的抗肿瘤效果。当巨噬细胞吞噬抑制性信号通路被CD47抗体阻断后,Poly(I:C)诱导IL-6的产生,促进下游PI3K的磷酸化,激活Rac GTPases,导致细胞骨架的重排,从而促进了巨噬细胞吞噬。本研究不仅为实体瘤免疫治疗提供新的策略,同时揭示了IL-6在CD47抗体肿瘤免疫治疗中的新机制。
中山大学中山医学院钟诚博士为论文第一作者,中山医学院陈俊教授为论文通讯作者。
与此同时,2021年12月14日,陈俊教授团队联合加拿大蒙特利尔临床研究所Andre Veillette院士团队在Cell Reports杂志在线发表题为Inflammatory macrophages exploit unconventional pro-phagocytic integrins for phagocytosis and anti-tumor immunity的最新研究论文。该研究阐明,炎性巨噬细胞利用整合素CD11a和CD11c促进肿瘤细胞吞噬,从而抑制肿瘤生长。
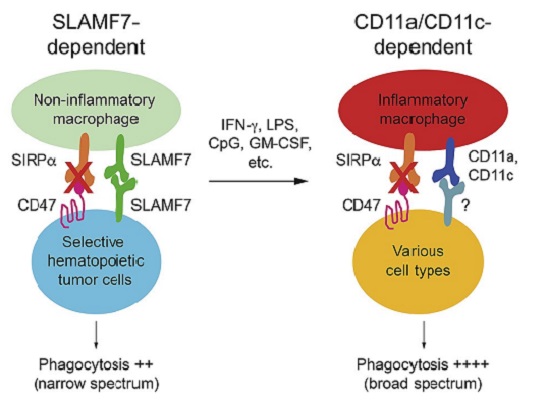
本文通过多种细胞因子IFNa、IFNb、IFNg、GM-CSF和Toll 样受体配体LPS、CpG诱导M1型巨噬细胞,发现M1型巨噬细胞可以吞噬更多种类的肿瘤细胞,该吞噬不依赖于巨噬细胞上FcRg,CD11b,SLAMF7,LRP1受体。通过检测巨噬细胞上受体,发现M1型巨噬细胞高表达整合素CD11a,CD11c及增加其与ICAM-1的结合能力。阻断CD11a和CD11c可以抑制巨噬细胞的吞噬功能。整合素家族由a(结合配体)链和b(信号传递)链组成。CD11a,CD11c和整合素b2结合。敲除整合素b2可以抑制巨噬细胞吞噬肿瘤细胞。通过表达突变整合素b2,发现b2胞内NPxF结构域对于巨噬细胞吞噬起关键作用。激活整合素b2可以激活其下游激酶,调控肌动蛋白聚合,从而促进巨噬细胞吞噬。体内实验表明巨噬细胞能更有效的通过整合素b2吞噬GM-CSF分泌的肿瘤细胞,从而抑制肿瘤生长。此外通过数据库分析,发现巨噬细胞高表达CD11c和病人愈合正相关。本次研究不仅阐明了在炎症因子作用下,巨噬细胞吞噬肿瘤细胞的作用机制,同时提示靶向巨噬细胞CD11a和CD11c可作为肿瘤免疫治疗靶点。
中山医学院陈俊教授和加拿大蒙特利尔临床研究所Andre Veillette院士为论文共同通讯作者。
(稿件来源:陈俊教授团队,初审:沈洪燕,审核:周家国,审核发布:张琪)



