我院曹楠教授团队建立心脏纤维化靶向给药治疗新策略
心肌梗死(myocardial infarction, MI)是由冠状动脉阻塞引起的一种常见的心脏疾病,在全球的发病率和死亡率居高不下。MI后,大量心脏成纤维细胞(cardiac fibroblasts, CFs)强烈激活,并分泌细胞外基质形成纤维化组织取代受损心肌组织,导致心室重塑和心功能进一步下降,最终发展为终末期心力衰竭。因此,在MI后如何有效抑制CFs的过度激活和增殖成为了减少纤维化和改善心脏功能的关键。目前,尚无有效的治疗方法可以阻止MI引起的病理性纤维化。由于不能特异性靶向输送到受损区域的CFs中,大多数药物试验未能达到预期效果,并引起全身毒副作用。因此,开发一种能够直接靶向CFs并具有高安全性和高效性的药物输送系统是心血管医学领域亟待解决的重大挑战。
2023年3月17号,我院曹楠教授与香港科技大学吴钧教授、中山大学孙逸仙纪念医院谢双伦主任合作,在ACS Nano期刊(中科院1区TOP,IF: 18.0)上发表了题为Cysteine-Based Redox-Responsive Nanoparticles for Fibroblast-Targeted Drug Delivery in the Treatment of Myocardial Infarction的论文,报道了一种基于还原型谷胱甘肽(GSH)响应性纳米粒子(NPs)平台的CFs靶向药物输送系统用于治疗心脏纤维化。

该研究首先发现CFs中GSH水平在MI后短时间内急剧升高这一特点,设计并合成了一种含有半胱氨酸(Cys)和聚乙二醇共聚物为主要成分的GSH响应性NPs。这种NPs能够在体外和体内稳定地包裹小分子药物,并在高浓度GSH环境下快速解聚释放药物。与此同时,研究团队通过高通量筛选方法,从生物活性小分子库中筛选出了一种具有高效抗纤维化作用的小分子药物—PF543,并将其包裹在Cys-8E NPs中形成PF543-NPs。PF543-NPs能够在体内持续地靶向释放到受损区域内的心脏成纤维细胞中,从而增强药物治疗效果,减少心脏纤维化程度,改善心脏功能。由于PF543-NPs可以定向释放到心脏受损区域激活的CFs中,可以减少其在其他器官中的分布,从而显著降低了药物肝肾毒性。
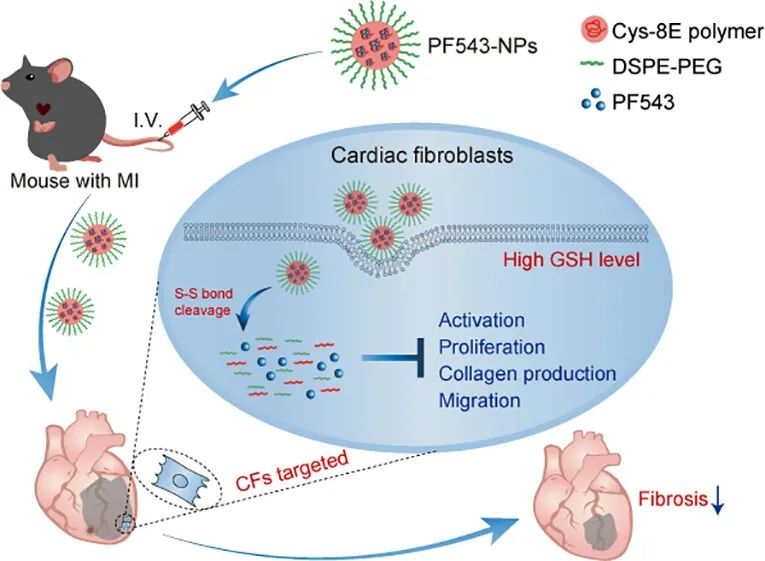
综上,该研究开发了一种基于GSH响应的NPs给药系统,能够将药物靶向递送至MI后心脏梗死区域内的活化CFs中,并实现对CFs的持续释放,从而减少心脏的不良重塑反应并提高抗纤维化功效。
【原文链接】
https://pubs.acs.org/doi/10.1021/acsnano.2c10042
(稿件来源:曹楠教授团队,初审:刘梦圆,审核:周家国,审核发布:张琪)



